PROPRIETA’ DEI VETRI : LA TENSIONE SUPERFICIALE
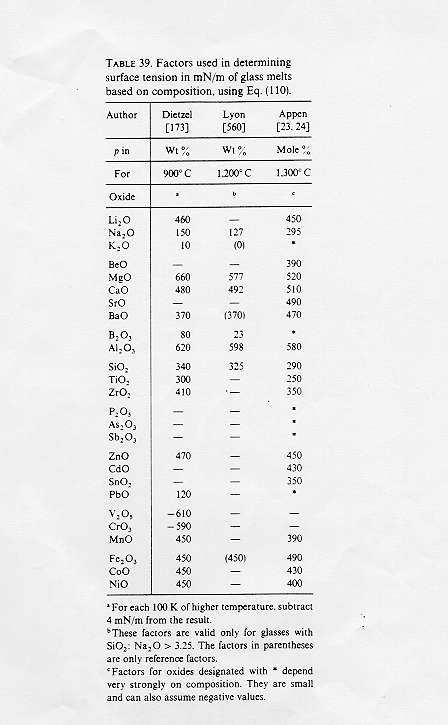
Una molecola all’interno di un fluido poiché è circondata completamente da altre molecole interagisce in maniera uniforme in tutte le direzioni, al contrario una molecola che si trova alla superficie del fluido subisce attrazione solo dalle molecole poste negli strati inferiori e quindi subirà una attrazione complessiva diretta verso l’interno del fluido.(Figura 1)
Fig.1

La superficie di un fluido ha quindi maggior energia libera del suo interno e quindi essa tende a contrarsi per raggiungere la più piccola area possibile cioè la superficie di una sfera. Il lavoro necessario a stendere su di un piano 1 cm2 di liquido è pari all’energia libera superficiale mentre la forza che direzionalmente si oppone a questo lavoro è detta tensione superficiale g .
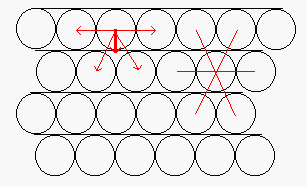
Come vediamo dalla figura 2 la forma che una goccia di liquido assume su di un piano dipende dalla tensione superficiale e dalla forza di gravità.
Fig. 2
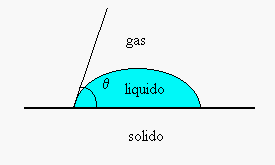
se q è l’angolo di contatto della goccia con la superficie solida allora è valida la relazione:
![]() (1)
(1)
si nota dalla (1) che se la tensione superficiale all’interfaccia solido-atmosfera è maggiore di quella all’interfaccia solido-liquido ![]() allora il cos q > 0 e quindi
allora il cos q > 0 e quindi ![]() . In questo caso si dice che il liquido bagna la superficie, come nel caso dell’acqua sul vetro. Se al contrario
. In questo caso si dice che il liquido bagna la superficie, come nel caso dell’acqua sul vetro. Se al contrario ![]() il cos q < 0 e quindi
il cos q < 0 e quindi ![]() , il liquido, come nel caso del mercurio su di un vetro non bagna la superficie.
, il liquido, come nel caso del mercurio su di un vetro non bagna la superficie.
Anche se l’angolo di contatto dipende da tre tensioni superficiali (o interfacciali) la bagnabilità di fatto dipende solo dalle entità relative di ![]() e
e ![]() .
.
1.1) Metodi di misura
1.1.1) Bubble pressure method
Un tubicino di platino di diametro noto viene immerso nel fuso, in esso viene insufflata dell’aria in modo che bolle d’aria gorgoglino nel fuso. Si varia la pressione dell’aria finché il raggio delle bolle di aria che fuoriescono dal capillare eguaglia il raggio del tubo. La tensione superficiale sarà data dalla relazione
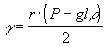
dove r = raggio del capillare, P = pressione dell’aria insufflata, l = lunghezza del capillare immerso nel fuso, r = densità del fuso.
1.1.2) Fiber method
Questo è un metodo utilizzato per le alte viscosità: una fibra di vetro viene sospesa in una muffola a temperatura controllata, essa subirà un allungamento sotto l’azione della forza di gravità che sarà in funzione della sua viscosità h mentre l’estremità della fibra tende ad assumere l’aspetto di una sfera sotto l’effetto della tensione superficiale. Tenendo conto di una forza addizionale K all’estremità della fibra l’elongazione E dopo un tempo t è in funzione della viscosità e della tensione superficiale:
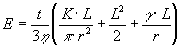
1.2) Dipendenza dalla composizione
Abbiamo visto che minori sono le mutue forze di attrazione tra le particelle costituenti un fuso e minore è la tensione superficiale.
1.2.1) vetro di silice SiO2
Il vetro di silice fusa è caratterizzato da legami a ponte O-Si molto forti, i tetraedri [SiO4] disponendosi in modo che alla superficie del fuso siano presenti gli ossigeni determinano un elevata tensione superficiale come si rileva dal valore di g sperimentalmente determinato.
Fig. 3
g
SiO2 = 280 mN /m (1200°)
1.2.2) vetro di B2O3
A causa del numero di coordinazione 3 il gruppo [BO3] assume una geometria triangolare planare e quindi tende a disporsi in superficie parallelamente all’interfaccia fuso-atmosfera, la tensione superficiale che, come abbiamo detto, è una forza applicata in una direzione perpendicolare alla interfaccia sarà dunque inferiore a quella della silice fusa. In effetti misure sperimentali hanno rilevato una g = 80 mN/m (900°).
1.2.3) Sistemi alcalino-silicatici
Fig. 4
§ 6.0a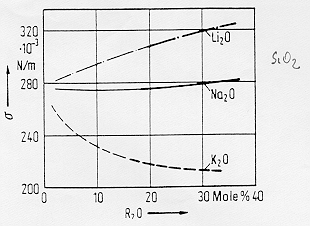
In figura 4 § 6.0a si notano, per un vetro di silice pura, effetti differenti a seconda dello stato del legame dello ione con l’ossigeno: lo ione Li+ che tra i metalli alcalini ha la più elevata forza di campo e quindi anche un maggiore potere di polarizzazione sul legame con l’ossigeno determina all’aumentare della concentrazione molare nel fuso un aumento della tensione superficiale. All’opposto lo ione K+ che ha una bassa forza di campo ha una maggiore polarizzabilità ed in questo caso la tensione superficiale diminuisce all’aumentare della concentrazione molare di R2O.
1.2.4) Effetto di cationi aggiunti
Fig. 5
§ 6.0b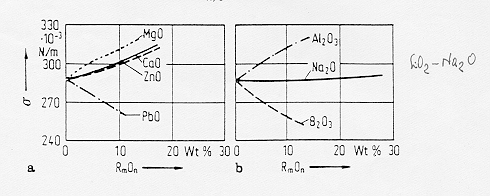
Dalla figura 5 § 6.0b si nota per un sistema sodio-silicatico un aumento della tensione superficiale all’aumentare della concentrazione molare di MgO, CaO, ZnO e Al2O3 mentre è da notare all’opposto l’effetto dell’aggiunta di PbO che fa decrescere il valore della tensione superficiale in virtù della forte polarizzabilità dello ione Pb++, anche l’aggiunta di B2O3 fa abbassare la tensione superficiale del vetro binario in quanto anche in questo caso sembra che i gruppi [BO3] si vadano a concentrare alla superficie.
1.2.5) Influenza degli anioni
Lo ione fluoruro F- in concentrazione dell’1% già ad 800°C abbassa la tensione superficiale g di 7 mN/m in quanto per il fatto di essere monovalente tende a concentrarsi alla superficie del fuso, lo ione SO42- riduce fortemente la tensione superficiale a temperature basse (800°C) mentre la riduzione della g è meno pronunciata a temperature più elevate , questo fenomeno è spiegabile ipotizzando un meccanismo superficiale di separazione di fase che produce per temperature basse un aumento della concentrazione superficiale dello ione solfato.
Per quanto detto esiste quindi un effetto atmosfera del forno: rispetto ad esperimenti condotti sotto vuoto la tensione superficiale si riduce in maniera variabile dipendente dalla atmosfera del forno.
1.2.6) Sistemi alcalino-boratici
Fig.6
§ 6.0c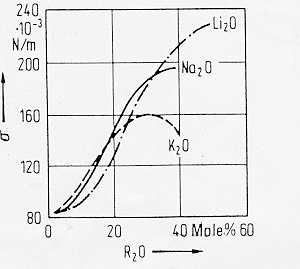
Anche in questo caso la tensione superficiale è governata dai gruppi [BO3] presenti in superficie, per un aggiunta di ioni alcalini solo gli ioni facilmente polarizzabili come il K+ riusciranno a raggiungere la superficie e a dar luogo al complesso ![]() ; quindi come vediamo dalla figura 6 § 6.0c si avrà inizialmente un effetto più marcato per il K+ che non per gli altri ioni alcalini, tuttavia ad alte concentrazioni di alcali questa struttura del fuso viene modificata (il reticolo tridimensionale comincia ad essere demolito) e il valore della tensione superficiale torna a diminuire.
; quindi come vediamo dalla figura 6 § 6.0c si avrà inizialmente un effetto più marcato per il K+ che non per gli altri ioni alcalini, tuttavia ad alte concentrazioni di alcali questa struttura del fuso viene modificata (il reticolo tridimensionale comincia ad essere demolito) e il valore della tensione superficiale torna a diminuire.
1.3) Dipendenza dalla temperatura
All’aumentare della temperatura i legami diventano sempre più deboli e questo produce una diminuzione della tensione superficiale, un incremento di 100 K in genere comporta una riduzione nella tensione superficiale di 4-10 mN/m. Fanno eccezione i vetri boratici per i quali all’aumentare della temperatura aumenta la mobilità dei gruppi [BO3] e quindi la loro orientazione preferenziale sulla superficie viene distrutta.
1.4) Influenze della tensione superficiale sul processo produttivo
1.4.1) formazione di corde
Durante la fusione del batch si formano corde di fusi che hanno proprietà chimico-fisiche diverse da quelle del fuso circostante, se queste ad esempio hanno minore tensione superficiale del resto del fuso esse tenderanno a distendersi sul fuso, se al contrario possiedono una tensione superficiale maggiore tenderanno a contrarsi fino ad assumere nei casi limite la forma di gocce galleggianti sulla superficie.
1.4.2) bagnabilità del batch
Durante il processo di fusione un passaggio importante è dato dalla interazione del fuso che si è formato con i materiali solidi del batch, se la tensione superficiale del fuso è sufficientemente bassa si ha una buona bagnabilità dei grani e quindi si può ridurre il tempo di permanenza del batch nel forno durante i primi stadi della fusione.
1.4.3) miscelazione
Il fuso che si forma durante il processo di fusione è in genere formato da miscele di fusi di differente composizione e quindi con differenti proprietà chimico-fisiche, se la tensione superficiale di un componente la miscela è molto maggiore delle altre questa tenderà ad assumere la superficie minima possibile e quindi il processo di diffusione sarà ostacolato per una ridotta superficie di contatto tra le fasi.
1.4.4) corrosione del refrattario
La corrosione del refrattario costituisce uno dei problemi tecnologici più importanti nell’industria del vetro, il punto critico è costituito dal contatto della superficie del bagno fuso con le pareti, la bagnabilità del refrattario da parte del fuso gioca quindi un ruolo importante.
Il refrattario che costituisce le pareti di un forno fusorio ha una porosità ben definita e la penetrazione del fuso nei pori del refrattario dipende dall’angolo di contatto q tra il fuso e la superficie del solido oltre che dalla tensione superficiale g e dal raggio del poro r, la seguente relazione definisce infatti la pressione di penetrazione P come:
![]()
tuttavia il refrattario non è costituito da pori "ideali" cioè privi di rugosità e di sezione perfettamente sferica, empiricamente Adams ha definito un angolo di contatto apparente j per il quale se j < 45° si ha avanzamento del fuso nel capillare e se invece j > 45° non si ha avanzamento.
1.4.5) Schiume
Fluidi con alta tensione superficiale tendono ad abbattere schiume che si possono formare alla superficie dei bagni del fuso nei forni fusori.
1.5) Calcolo della tensione superficiale
Un calcolo teorico di g è possibile quando la concentrazione dei componenti alla superficie è la stessa di quella all’interno del fuso, questo però non sempre si verifica, abbiamo infatti visto che la riduzione della tensione superficiale favorisce l’aumento in concentrazione di specie chimiche.
Dietzel, Lyon, Appen hanno calcolato dei coefficienti teorici validi per limitate regioni di applicazione. Figura 7 § 6.1
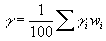
Fig. 7
§ 6.1